Bảng tính tan là một trong những kiến thức trọng tâm trong chương trình môn Hóa học từ lớp 8 đến lớp 12.
Bảng tính tan hóa học bao gồm rất nhiều kiến thức và cả những quy tắc do vậy mà việc ghi nhớ kiến thức này không hề dễ dàng. Chính vì vậy các bạn hãy tra cứu chi tiết để chủ động giải và xử lý những bài toán về hóa học hay khi làm các thí nghiệm. Đồng thời các bạn cần phải kết hợp với việc làm nhiều bài tập về nhà, việc thực hành nhiều sẽ giúp bạn nắm được tính chất tan của một số chất thường dùng. Các bạn sẽ dần quen thuộc với bảng tính tan các muối hay của các chất khác và dễ nhớ hơn nhiều khi được lặp lại thường xuyên. Vậy sau đây là toàn bộ kiến thức về bảng tính tan kèm theo cách học mời các bạn cùng theo dõi.
I. Bảng tính tan là gì?
Bảng tính tan gồm các hàng và các cột. Cột là các cation kim loại, còn hàng là các anion gốc axit (hay OH-). Với một chất cụ thể, ta sẽ xác định ion dương và ion âm, gióng theo hàng và cột tương ứng ta sẽ biết được trạng thái của chất đó tại một ô.
Để giải những bài toán hóa học về tính tan, kết tủa hay sự bay hơi trong phòng thí nghiệm thì học sinh cần phải có được phiếu tính tan. Do vậy, những kiến thức trong bảng tính tan đầy đủ thì bạn cần phải nắm rõ.
II. Chất tan và chất không tan
Ở trong nước có chất tan và chất không tan, có chất tan ít, có chất tan nhiều.
Tính tan của một số axit, bazo, muối
- Bảng tính tan của Axit: Hầu hết axit tan được trong nước, trừ axit silixic.
- Bảng tính tan của Bazo: phần lớn các bazo không tan trong nước, trừ một số như: KOH, NaOH,..
- Bảng tính tan của Muối:
- Những muối natri, kali đều tan.
- Những muối nitrat đều tan.
- Phần lớn các muối clorua, sunfat tan được. Nhưng phần lớn các muối cacbonat không tan.
III. Độ tan của một chất trong nước
1, Định nghĩa độ tan
Độ tan (kí hiệu là S) của một trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
2, Những yếu tố ảnh hưởng đến độ tan
- Độ tan của chất rắn trong nước phụ thuộc vào nhiệt độ, trong nhiều trường hợp, khi nhiệt độ tăng thì độ tan cũng tăng theo. Số ít trường hợp, nhiệt độ tăng độ tan lại giảm.
- Độ tan của chất khí trong nước phụ thuộc vào nhiệt độ và áp suất. Độ tan của chất khí trong nước sẽ tăng, nếu ta giảm nhiệt độ và tăng áp suất
IV. Đặc tính tan trong nước của Axit, Bazơ và muối
Các hợp chất khác nhau có đặc tính tan khác nhau, tổng hợp chung có thể rút ra như sau:
- Axit: Hầu hết các axit đều tan trong nước, trừ Axit Silicic [SiOx(OH)4-2x]n như H2SiO3, H4SiO4,…
- Bazơ: Các bazơ hầu hết không thể tan trong nước trừ một số hợp chất như : KOH, NaOH…
- Muối: Muối kali, natri đều tan; muối nitrat đều tan; hầu hết muối clorua, sunfat đều tan được nhưng hầu như các muối cacbonat đều không tan.
Mẹo nhỏ:
Có bài thơ ngắn về tính tan như thế này:
Loại muối tan tất cảlà muối ni-tơ-ratVà muối axetatBất kể kim loại nào.
Những muối hầu hết tanLà clorua, sunfatTrừ bạc, chì cloruaBari, chì sunfat.
Những muối không hòa tanCacbonat, photphatSunfua và sunfitTrừ kiềm, amoni.
V. Ý nghĩa bảng tính tan
Bảng tính tan cho ta biết, tính tan các chất trong nước: chất nào tan được trong nước, chất nào không tan trong nước, chất nào ít tan trong nước, chất nào dễ phân hủy, bay hơi …Từ đó ta có thể làm các bài nhận biết và các bài toán có kiến thức liên quan.
Thí dụ: Nhận biết dung dịch muối sắt (III) bằng dung dịch NaOH tạo thành kết tủa màu nâu đỏ Fe(OH)3
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
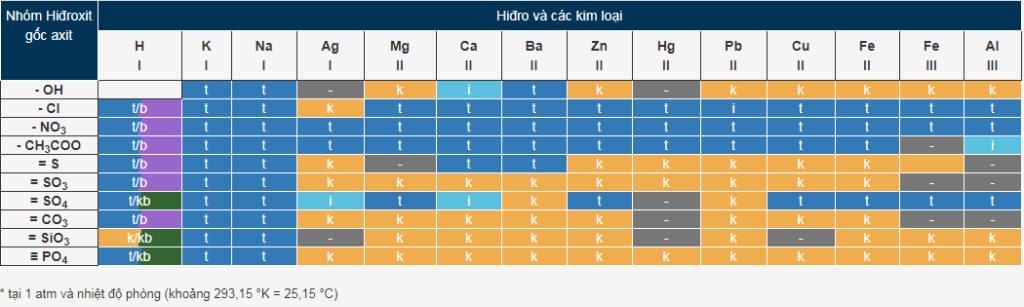
VI. Bảng tính tan hóa học
Nắm được bảng tính tan là nội dung quan trọng trong giải các bài toán hóa học. Ở nhiệt độ phòng, áp suất 1atm, ta có bảng tính tan hóa học như sau:
Trong đó:
- t - tan;
- k - không tan;
- b- bay hơi;
- i - tan ít;
- “-” là hợp chất không tồn tại trong nước.
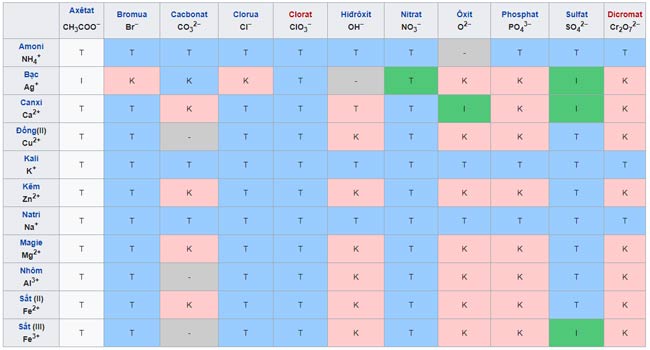
VII. Bảng tính tan của muối và hiđroxit
VIII. Cách ghi nhớ bảng tính tan
Hợp chất Tính chất TrừAxit (xem ở cột ion H+ và anion gốc axit tương ứng).
Đều tan.
H2SiO3
Bazo (xem ở hàng ion OH- và các cation tương ứng).
Không tan.
LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2, NH4OH.
Muối liti Li+
Muối natri Na+
Muối kali K+
Muối amoni NH4+
Đều tan.
Muối bạc Ag+
Không tan (thường gặp AgCl).
AgNO3, CH3COOAg.
Muối nitrat NO3-
Muối axetat CH3COO-
Đều tan.
Muối clorua Cl-
Muối bromua Br-
Muối iotua I-
Đều tan.
AgCl: kết tủa trắng
AgBr: kết tủa vàng nhạt
AgI: kết tủa vàng
PbCl2, PbBr2, PbI2.
Muối sunfat SO42-
Đều tan
BaSO4, CaSO4, PbSO4: trắng
Ag2SO4: ít tan
Muối sunfit SO32-
Muối cacbonnat CO32-
Không tan
Trừ muối với kim loại kiềm và NH4+
Muối sunfua S2-
Không tan
Trừ muối với kim loại kiềm, kiềm thổ và NH4+
Muối photphat PO43-
Không tan
Trừ muối với Na+, K+ và NH4+
IX. Muối nào tan trong nước và muối nào không tan?
- Muối có gốc axit vẫn còn nguyên tử Hidro là muối axit. Các muối này hầu như tan tốt trong nước điển hình như (-HCO3, - HSO3, - HS).
- Muối của nhóm nitrat, muối Axetat tan tốt trong nước
- Muối Photphat (-PO4)3- của các kim loại kiềm thì tan, còn lại thì không tan.
- Muối gốc Cacbonat (- CO32-) hầu như không tan, ngoại trừ muối của các kim loại kiềm. Các kim loại Hg, Al, Cu, Fe
X. Màu sắc của một số Hidroxit không tan
- Cu(OH)2: kết tủa xanh lam
- Fe(OH)2: kết tủa lục nhạt
- Fe(OH)3: kết tủa nâu đỏ
- Mg(OH)2: kết tủa trắng không tan trong kiềm dư.
- Al(OH)3, Zn(OH)2, Pb(OH)2, Sn(OH)2: kết tủa trắng tan trong kiềm dư.
XI. Mẹo học thuộc nhanh bảng tính tan
a. Học thuộc các quy tắc rút gọn về tính tan
Như đã chia sẻ ở trên về khả năng tan của muối, axit, bazo trong nước. Các bạn có thể dựa vào những điểm này để ghi nhớ tính chất tan của các hoạt chất này trong nước. Cụ thể như sau:
*Đối với muối
- Muối có gốc halogen như -Cl, -Br, -F… đa phần đều có khả năng tan trong nước.
- Muối gốc Silicat (SiO3), Sunfit (SO3), Cacbonat (CO3) hay Sunfua (S) đều sẽ không tan hoặc khó tan trong nước. Tuy nhiên, lưu ý rằng khi các gốc này kết hợp với kim loại có tính kiềm sẽ tạo ra các hợp chất muối tan được trong nước.
- Nhìn chung, các kim loại kiềm như K, Na, Li… sau khi kết hợp thành muối đều có thể tan trong nước. Các bạn có thể thấy điều này khi nhìn các hàng có chưa kim loại tính kiềm, nó đều được ký hiệu bằng chữ T, tức là các chất dễ tan.
- Muối gốc Sunfat (SO4) hầu như đều tan trong nước và trừ muối sunfat của kim loại bari không tan.
- Muối có gốc halogen như F, Cl, Br, I phần đa đều tan được trong nước. Một điều đặc biệt là khi bạc tác dụng với các nguyên tố trong nhóm này sẽ không tan mà tạo ra kết tủa với các màu đặc trưng. Đây là cách để các bạn có thể nhận biết các nguyên tố nhóm halogen dễ dàng khi làm các bài toán nhận biết nguyên tố hóa học. Trên bảng tính tan, bạc kết hợp với Cl sẽ được đánh dấu bằng chữ k, nghĩa là không tan được trong nước.
Lưu ý: Có một số muối không tồn tại hoặc nó có thể bị phân huỷ ngay trong nước, được ký hiệu bằng dấu “-“ trong bảng tính tan. Những trường hợp này, không có nhiều nên các bạn nhớ lưu vào để học nha.
*Đối với axit và bazo
- Đa phần các axit đều tan dễ dàng trong nước. Chỉ riêng H2CO3 thì dễ dàng bị phân huỷ trong nước và các axit có gốc silicic như H2SiO3, H4SiO4… thì không tan.
- Còn với các bazo thì hầu như không tan trong nước. Riêng với bazo của kim loại kiềm như Li, K, N đều tan trong nước và các bazo của kim loại nhóm 2 sẽ ít tan trong nước.
b. Học thuộc bảng tính tan qua thơ
Bazơ, những chú không tan:Đồng, nhôm, crôm, kẽm, mangan, sắt, chìÍt tan là của canxiMagie cũng chẳng điện li dễ dàng.
Muối kim loại kiềm đều tanCũng như nitrat và “nàng” hữu cơMuốn nhớ thì phải làm thơ!Ta làm thí nghiệm bây giờ thử coi,
Kim koại I (IA), ta biết rồi,Những kim loại khác ta “moi” ra tìmPhotphat vào nước đứng im (trừ kim loại IA)Sunfat một số “im lìm trơ trơ”:Bari, chì với S-rÍt tan gồm bạc, “chàng khờ” canxi,
Còn muối clorua thìBạc đành kết tủa, anh chì cố tan (giống Br- và I-)
Muối khác thì nhớ dễ dàng:Gốc SO3 chẳng tan chút nào! (trừ kim loại IA)Thế gốc S thì sao? (giống muối CO32-)Nhôm không tồn tại, chú nào cũng tanTrừ đồng, thiếc, bạc, mangan, thuỷ ngân, kẽm, sắt không tan cùng chì
Đến đây thì đã đủ thi,Thôi thì chúc bạn trường gì cũng vô!


