
CO2 + Ca(OH)2 → CaCO3 + H2O | CO2 ra CaCO3 | Ca(OH)2 ra CaCO3
Phản ứng CO2 + Ca(OH)2 → CaCO3 + H2O
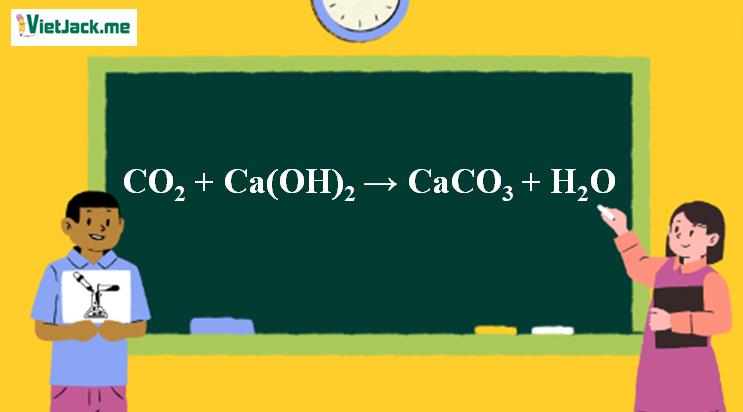
1. Phương trình phản ứng CO2 tác dụng Ca(OH)2
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
kết tủa trắng
2. Điều kiện phản ứng CO2 tác dụng với dung dịch Ca(OH)2
Không có
3. Cách tiến hành phản ứng cho CO2 tác dụng với dung dịch Ca(OH)2
Sục khí CO2 qua dung dịch nước vôi trong Ca(OH)2.
4. Hiện tượng hóa học CO2 tác dụng với dung dịch Ca(OH)2
Xuất hiện kết tủa trắng Canxi cacbonat (CaCO3) làm đục nước vôi trong.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của CO2 (Cacbon dioxit)
CO2 mang tính chất hoá học tiêu biểu của một oxit axit nên phản ứng được với dung dịch bazo tạo thành muối và nước.
5.2. Bản chất của Ca(OH)2 (Canxi hidroxit)
Ca(OH)2 là dung dịch kiềm của một oxit bazo mạnh và có tính bazo trung bình-mạnh nên tác dụng được với oxit axit.
6. Bài toán CO2 dẫn vào dung dịch Ca(OH)2
Do ta không biết sản phẩm thu được là muối nào nên phải tính tỉ lệ T:
Ca(OH)2 + CO2 → CaCO3↓ + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
Đặt T = nCO2 : nCa(OH)2
Nếu T ≤ 1: chỉ tạo muối CaCO3
Nếu T = 2: chỉ tạo muối Ca(HCO3)2
Nếu 1 < T < 2: tạo cả muối CaCO3 và Ca(HCO3)2
Hấp thụ CO2 vào nước vôi trong thấy có kết tủa, thêm NaOH dư vào thấy có kết tủa nữa suy ra có sự tạo cả CaCO3 và Ca(HCO3)2
Hấp thụ CO2 vào nước vôi trong thấy có kết tủa, lọc bỏ kết tủa rồi đun nóng nước lọc lại thấy kết tủa nữa suy ra có sự tạo cả CaCO3 và Ca(HCO3)2.
7. Tính chất hóa học của CO2
Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
7.1. CO2 là oxit axit
- CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu):
CO2 (k) + H2O (l) ⇔ H2CO3 (dd)
- CO2 tác dụng với oxit bazơ → muối:
CaO + CO2 → CaCO3 (tº)
- CO2 tác dụng với dung dịch kiềm → muối + (H2O)
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
7.2. CO2 bền
Ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh
2CO2 ⇔ 2CO + O2 (tº)
CO2 + 2Mg → 2MgO + C (Đây là nguyên nhân không sử dụng CO2 để dập tắt các đám cháy kim loại)
CO2 + C → 2CO
7.3. Sản xuất ure
CO2 + 2NH3 → NH4O - CO - NH2 (amoni cacbamat)
NH4O - CO - NH2 → H2O + (NH2)2CO (180ºC; 200at)
8. Ứng dụng của CO2
Khí co2 được dùng để làm lạnh, bảo quản thực phẩm, tạo ra nước soda và nhiều sản phẩm khác. Ngoài ra CO2 có vai trò trong quá trình quang hợp của thực vật và trong chu trình phát thải cacbon của Trái Đất. Khí co2 có tác dụng vô cùng trò quan trọng trong việc duy trì nhiệt độ trái đất, tạo ra sự chuyển hóa của các chất hữu cơ và tham gia vào nhiều quá trình công nghiệp khác.
9. Tính chất hóa học của Ca(OH)2
Dung dịch Ca(OH)2 có có tính bazơ mạnh. Mang đầy đủ tính chất của bazơ:
Tác dụng với axit:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Tác dụng với muối:
Ca(OH)2 + Na2CO3 → CaCO3↓ + 2NaOH
Tác dụng với oxit axit:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Chú ý: Khi sục từ từ khí CO2 tới dư vào dung dịch Ca(OH)2 thì
+ Ban đầu dung dịch vẩn đục:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
+ Sau đó kết tủa tan dần và dung dịch trong suốt:
CO2 + H2O + CaCO3 → Ca(HCO3)2
10. Bài tập vận dụng
Câu 1. Dẫn 4,48 lít khí CO2 (ở đktc) qua 250ml dung dịch NaOH 1M. Cô cạn dụng dịch sau phản ứng thu được m gam muối khan. Tính giá trị của m?
A. 31,5 g
B. 21,9 g
C. 25,2 g
D. 17,9 gam
Lời giải:
Đáp án: D
Giải thích:
nCO2= 0,2 mol
nNaOH = 0,25 mol
Ta thấy: 1< T < 2 nên tạo ra 2 muối NaHCO3 và Na2CO3
Gọi x và y lần lượt là số mol của NaHCO3 và Na2CO3
Ta có các phương trình phản ứng
CO2 + NaOH → NaHCO3 (1)
x ← x ← x (mol)
CO2 + 2NaOH → Na2CO3 (2)
y ← 2y ← y (mol)
Theo bài ra và phương trình phản ứng ta có hệ phương trình như sau
nCO2 = x + y = 0,2 (3)
nNaOH = x + 2y = 0,25 (4)
Giải hệ phương trình ta có x = 0,15 (mol) và y = 0,05 (mol)
Khối lượng muối khan thu được:
mNaHCO3 + mNa2CO3 = 84.0,15 + 106.0,05 = 17,9 gam
Câu 2. Hấp thụ hoàn toàn 15,68 lít khí CO2(đktc) vào 500ml dung dịch NaOH có nồng độ C mol/lít. Sau phản ứng thu được 65,4 gam muối. Tính C.
A. 1,5M
B. 3M
C. 2M
D. 1M
Lời giải:
Đáp án: C
Giải thích:
nCO2 = 0,7 mol
Gọi số mol của muối NaHCO3và Na2CO3 lần lượt là x và y
Ta có các phương trình phản ứng hóa học:
CO2+ NaOH → NaHCO3 (1)
x ← x ← x (mol)
CO2 + 2NaOH → Na2CO3 (2)
y ← 2y ← y (mol)
Theo bài ra và phương trình phản ứng ta có hệ phương trình như sau
nCO2= x + y = 0,7 (3)
Khối lượng của muối là:
84x + 106y = 65.4 (4)
Giải hệ từ (3) và (4) ta được: x = 0,4 (mol) và y = 0,3 (mol)
Từ phương trình phản ứng ta có: n = x + 2y = 0,4 + 2.0,3 = 1 (mol)
Vậy nồng độ của 500ml ( tức 0,5 l) dung dịch NaOH là C = n/V = 1/0,5 = 2M
Câu 3. Quá trình tạo thành thạch nhũ trong các hang động đá vôi kéo dài hàng triệu năm. Quá trình này được giải thích bằng phương trình hóa học nào sau đây ?
A. Ca(HCO3)2 → CaCO3 + CO2 + H2O
B. Mg(HCO3)2→ MgCO3 + CO2 + H2O
C. CaCO3+ CO2 + H2O → Ca(HCO3)2
D. CaCO3 + 2H+ → Ca2+ + CO2 + H2O
Lời giải:
Đáp án: A
Giải thích:
Quá trình tạo thạch nhũ trong hang động là do: Ca(HCO3)2→ CaCO3 + CO2 + H2O.
phản ứng nghịch: CaCO3 + CO2 + H2O → Ca(HCO3)2 giải thích sự xâm thực của nước mưa
Câu 4. Để phòng nhiễm độc CO, là khí không màu, không mùi, rất độc người ta sử dụng mặt nạ với chất hấp phụ là
A. đồng (II) oxit và mangan oxit
B. đồng (II) oxit và magie oxit.
C. đồng (II) oxit và than hoạt tính.
D. than hoạt tính.
Lời giải:
Đáp án: D
Giải thích:
Câu 5. Từ các sơ đồ phản ứng sau:
2X1 + 2X2 → 2X3 + H2↑
X3 + CO2 → X4
X3 + X4 → X5+ X2
2X6 + 3X5 + 3X2 → 2Fe(OH)3↓ + 3CO2↑ + 6KCl
Các chất thích hợp tương ứng với X3, X5, X6 lần lượt là
A. KHCO3, K2CO3, FeCl3.
B. KOH, K2CO3, Fe2(SO4)3.
C. KOH, K2CO3, FeCl3.
D. NaOH, Na2CO3, FeCl3.
Lời giải:
Đáp án: C
Giải thích:
Link nội dung: https://diendanxaydung.net.vn/co2-caoh2-a32837.html